Shrinidh Joshi, Medizintechnik-Berater on Kolabtree, provides 3 tips for successful Medizinprodukt Entwicklung, die Ihnen hilft, Ihr Produkt schnell auf den Markt zu bringen.
When you have an idea (either on a back of a ‘napkin’ or still brainstorming) for the development of a new medical device, it is very much likely that your idea will be disruptive like ‘no other’ and it will have a significant impact on the Gesundheitswesen or it is just another way to look at the things. There is also a possibility that your product will help to resolve some of the current challenges for example ‘form factor’ and bulkiness of the spirometer device was a huge challenge until the discovery of portable, hand-held spirometer devices. Similarly, the discovery of blood glucose monitors was transformative like no other for millions of diabetics.
Es ist nicht notwendig, ein medizinisches Gerät zu entwickeln, das außergewöhnlich oder störend ist. Ein medizinisches Gerät, das den bestehenden Nutzern einen Mehrwert bietet, hat auch die Chance, den Nutzern Vorteile zu bieten, z. B. Software als medizinisches Gerät wie BlueStar [1] das Diabetikern beim Lebensstil- und Medikamentenmanagement hilft. Das größte Dilemma für Neugründungen von Medizinprodukten ist die Frage, ob ihr Gerät einen profitablen Anteil am Markt erobern kann. In den meisten Fällen liegt das Problem entweder in der Qualitätskontrolle oder der Gültigkeit des Medizinprodukts oder in der Komplexität der Markteinführung eines Medizinprodukts begründet. Für Neugründungen von Medizinprodukten würde ich sagen, dass beides zum Scheitern Ihres Projekts führen kann, wenn Sie nicht von Experten durch den Prozess geführt werden. Wenn Sie ein medizinisches Gerät entwickelt haben, das das Potenzial hat, den Markt zu verändern und neue Behandlungsmethoden einzuführen, haben Sie vielleicht nicht an die regulatorischen Anforderungen gedacht, die für diese Art von Gerät gelten, oder die Aufsichtsbehörden sind nicht in der Lage, Ihr Gerät zu klassifizieren. Ich habe mit einem Unternehmen zusammengearbeitet, das eine brillante Idee hatte, ein therapeutisches Gerät mit einem diagnostischen Gerät zu kombinieren, um dem Endverbraucher einen durchgängigen Nutzen zu bieten. Die Zulassungsbehörde war jedoch verwirrt, ob sie das Gerät als Arzneimittel oder unter 510(k) als diagnostisches Gerät einstufen sollte. Daher ist ein ganzheitlicher Ansatz, der alle Aspekte der Designvalidität, der Qualitätskontrolle und des regulatorischen Rahmens berücksichtigt, sinnvoller, als sie nur bei Bedarf anzugehen. Es erfordert Präzision in jeder Phase - von der Produktidee über Design und Entwicklung, Konformität, Tests und Scale-up bis hin zur Vermarktung des Produkts.
In diesem Artikel werden wir einen Blick auf die Entwurfs- und Entwicklungsphase des Entwicklungsprozesses von Medizinprodukten werfen. Dieser Schritt ist, wie man meinen könnte, die wichtigste Phase im Lebenszyklus von Medizinprodukten. Wenn Sie als Medizinprodukt-Startup einen wichtigen Schritt bei der Definition oder Konzeption Ihres Medizinprodukts auslassen, riskieren Sie die Nichteinhaltung der Vorschriften der Aufsichtsbehörden, und Ihr Produkt wird es nicht auf den Markt schaffen können. Selbst wenn es Ihnen gelingt, die behördlichen Hürden für ein unzureichend definiertes oder konzipiertes Produkt zu umgehen, kann es am Ende seine Ansprüche an den beabsichtigten Einsatz oder die Vorteile gegenüber seinen Vorgängern oder Konkurrenten nicht erfüllen. Auf der anderen Seite birgt ein gut definiertes und konzipiertes Produkt ein großes Potenzial für seine Ansprüche an die Marktdurchdringung und die letztendliche Marktakzeptanz.
Wie bei jedem Produkt des Gesundheitswesens, ob es sich nun um ein Medikament oder ein medizinisches Gerät handelt, erfordert es ein beträchtliches Maß an Aufwand und Akribie, um die richtige Lösung zu liefern, die den Anforderungen des Kunden gerecht werden kann. Als Startup im Bereich Medizinprodukte müssen Sie sicherstellen, dass alle Beteiligten mit dem Produktumfang, den Ergebnissen, der Definition, der Spezifikation, dem Design und dem Formfaktor, der Risikominderungsstrategie und den regulatorischen Anforderungen übereinstimmen. Im Wesentlichen sollten alle oben genannten Bemühungen auf die bestmögliche Qualität Ihres Medizinprodukts ausgerichtet sein.
Entwicklung medizinischer Geräte: Vom Produkt zur Entdeckungsphase
1. Produktidee und Konzeptualisierung
The first step in medical device innovation is to analyze and identify the medical device market. As mentioned above, you are analyzing to see if your device is meeting unmet medical needs like early diagnosis of a difficult to cure disease or it is providing a more efficient way to manage a chronic disease. The problem statement for your medical device could be a novel or a better way to monitor adherence to the treatment regimen, monitoring ailment and health, improving drug delivery minimizing the drug requirements and adverse drug events, using künstliche Intelligenz, maschinelles Lernen, Deep Learning, or real-world insights etc. Innovative software can also be defined and approved as a medical device under a software as a medical device (SaMD) category.
Die Identifizierung des Bedarfs mit der Nachfrage ist ein wichtiger Schritt bei der Erstellung eines Angebots für Medizinprodukte, abgesehen davon, dass es den Vorschriften entspricht. Der Erfolg dieses Vorhabens hängt in hohem Maße von zwei Dingen ab:
- Die Lücke zwischen dem Bedarf des Zielmarktes und dem, was die Entwickler von Medizinprodukten als Bedarf wahrnehmen; je geringer die Lücke ist, desto besser sind die Vorgaben für die Produktdefinition;
- Eine starke Produktdefinition wird durch die Analyse der Marktbedürfnisse gewonnen.
Der gesamte Entwicklungsprozess von Medizinprodukten lässt sich wie in Abbildung 1 unten dargestellt vereinfachen.
Als neu gegründetes Unternehmen im Bereich Medizinprodukte ist es wichtig, dass Sie Ihre wissenschaftlichen und technischen Innovationen durch Flexibilität unterstützen, um den Entscheidungsprozess in Bezug auf die Regulierungsbehörden schneller zu durchlaufen, was durch strategische Kontrollpunkte in jeder Phase des Entwicklungsprozesses von Medizinprodukten erreicht werden kann. Betrachten Sie dies aus dem Blickwinkel des Produktlebenszyklus: Von der ersten Idee bis zur Markteinführung und von der behördlichen Zulassung bis zur Marktakzeptanz werden Sie jedes Mal vor Herausforderungen stehen. Der Punkt ist, dass Herausforderungen und die Entwicklung von Medizinprodukten miteinander verwoben sind und nur durch wissenschaftliche/technische Impulse auf der Entwicklungsseite und durch wissenschaftlich fundierte behördliche Entscheidungen auf der Zulassungsseite entflochten werden können.
2. Geräteklassifizierung
Nach der Produktidee und den definierten Merkmalen besteht der nächste Schritt darin, die risikobasierte regulatorische Klassifizierung für Ihr Produkt zu überprüfen. Sie müssen sicherstellen, dass Sie das mit Ihrem Produkt verbundene Risiko ermitteln und die entsprechende Klasse auf der Grundlage des Marktes, in den Sie eintreten wollen, auswählen. In dieser Phase müssen Sie möglicherweise auch sicherstellen, dass der Verwendungszweck Ihres Produkts klar definiert ist. Dies ist sehr wichtig, und wenn Sie eine 510(k)-Zulassung planen, müssen Sie sicherstellen, dass die Zweckbestimmung Ihres Produkts mit der des Prädikatsprodukts übereinstimmt.
Je nachdem, an welchem geografischen und regulatorischen Standort Sie Ihr Medizinprodukt beantragen wollen, ob in den USA oder bei der Europäischen Kommission, müssen Sie Ihr Produkt entweder gemäß dem Medical Device Classification Panel (US FDA-Klassifizierung von Medizinprodukten) oder MEDDEV 2.4/1 Rev. 9 (DE Anleitung MEDDEV), beziehungsweise. Der bei weitem größte Teil Ihres Antrags entfällt auf den Abschnitt über die Klassifizierung von Medizinprodukten. In diesem Abschnitt werden die regulatorischen Anforderungen für Ihr Produkt festgelegt. Je nach der von Ihnen gewählten Klasse des Medizinprodukts ist es sinnvoll, nach bestehenden Leitfäden zu suchen, die von den Regulierungsbehörden veröffentlicht wurden. In den USA beispielsweise ist es in der Hälfte der Fälle möglich, dass die FDA bereits einen für Ihren Antrag relevanten Leitfaden herausgegeben hat. Ein solcher Leitfaden kann als Nachschlagewerk für den beschleunigten Prüfzyklus dienen und die Chancen auf eine Zulassung bei Ihrem ersten Antrag erhöhen. Diese Leitfäden werden veröffentlicht, um sowohl innovativen Medizintechnikunternehmen wie dem Ihren als auch den Prüfern der Behörde eine schnellere Prüfung der Anträge zu ermöglichen. Außerdem müssen Sie nach bereits bestehendem geistigen Eigentum an der vorgeschlagenen Idee oder Ähnlichem suchen; dies könnte Sie daran hindern, den Mechanismus oder die Technologie zu verwenden. Um eine vollständige Entdeckungsphase durchzuführen, ist ein starkes Entwicklungsteam von entscheidender Bedeutung. Dies kann ein Fallstrick sein, wenn das Team nicht sehr erfahren ist. In jedem Fall können Sie sich für ein internes Team, einen Berater oder ein Ingenieurbüro für medizinische Geräte entscheiden.
Die wichtigste Überlegung für Unternehmen bei der Suche nach einem internen oder externen Berater Berater für Medizinprodukte ist, dass sie über Fachwissen in den folgenden Bereichen verfügen sollten:
- Technik und Design
- Menschliche Faktoren und Usability Engineering
- Klinische und wissenschaftliche Kenntnisse in der Medizinbranche
- Regulatory affairs and quality assurance
- Recht des geistigen Eigentums
3. Entdeckungsphase
The discovery phase where you will take your idea into the initial designing stage and develop prototypes for your device. This stage involves a lot of brainstorming with engineers, design consultants and your team to make 3D prototypes through simulations and computer-assisted designs and test those prototypes for proof-of-concept. You should also start looking at the FDA guidance documents to find out which critical functionality tests are pertinent to your device and start using them as a decision-matrix for finalizing the ideal design of your device. For the startups which are still boot-strapping for finances, it will be cost-prohibitive to run all the tests as per the guidance documents so I would rather advise to choose one or two most relevant tests and use them for design optimization. Once you have optimized your medical device concept and design, you may now proceed for regulatory approval and commercialization. It is noteworthy here that the US FDA critical path initiative focused on the science of development: better toxicology, Biomarker, improved klinische StudienDiese Initiative, wie auch andere, einschließlich der Re-Engineering-Initiativen der 1990er Jahre und der Gesetzesänderungen, die mit den Nutzungsgebühren für Produkte einhergingen, untersuchte jedoch nicht die regulatorische Struktur des Zulassungsverfahrens selbst und die Frage, wie die regulatorische Struktur die Entscheidungen in der Wissenschaft der Entwicklung bestimmt.
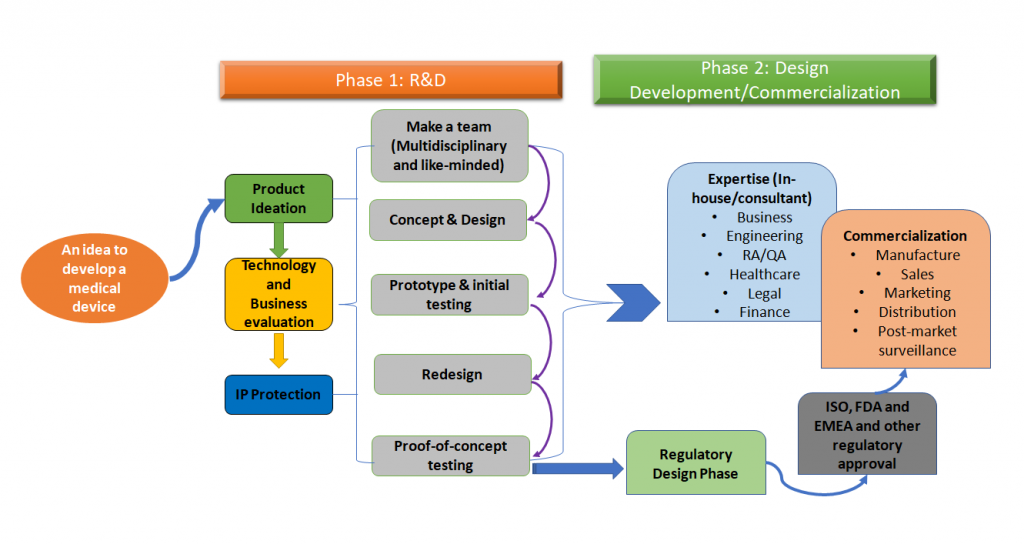
Abbildung 1: Die Entwicklung von Medizinprodukten ist ein ganzheitlicher Prozess. Dies ist eine vereinfachte Version des Prozesses, die einen phasenweisen Ansatz darstellt, aber idealerweise müssen alle Schritte dieses gesamten Prozesses frühzeitig während der Entwicklung des Medizinprodukts festgelegt werden (angepasst an [1,2]).
Benötigen Sie Hilfe bei der Entwicklung eines Medizinprodukts? Durchsuchen Sie Berater für medizinische Geräte auf Kolabtree. Es ist kostenlos, einen Experten zu kontaktieren oder Ihr Projekt einzustellen.
Lesen Sie auch: Wie viel kostet es, einen Berater für Medizinprodukte zu engagieren?
Referenzen
- https://www.welldoc.com/health-plans/
- https://ec.europa.eu/docsroom/documents/10337/attachments/1/translations
- FDA, 2005, Total Product Lifecycle, FDA-CDRH Präsentation von CDRH-Direktor Dr. David Feigal, http://www.fda.gov/cdrh/strategic/presentations/ tplc.html
Alle Artikel dieser Serie:
Entwicklung und Design von Medizinprodukten: Ein definitiver Leitfaden
Entwicklung medizinischer Geräte: 3 Tipps für den Erfolg
Entwurf medizinischer Geräte: Der wesentliche, schrittweise Leitfaden
Vermarktung von Medizinprodukten: 9 Schritte von der Skizze bis zur Markteinführung
Wie man die Herausforderungen bei der Kommerzialisierung von Medizinprodukten meistert
Markteinführung medizinischer Geräte: Die wichtigsten Schritte zur Markteinführung Ihres Produkts
Post-Market Surveillance von Medizinprodukten: Ein umfassender Leitfaden







