シュリニード・ジョシ, メドテック・コンサルタント on Kolabtree, provides 3 tips for successful 医療機器 を開発し、製品の迅速な市場投入を支援します。
When you have an idea (either on a back of a ‘napkin’ or still brainstorming) for the development of a new medical device, it is very much likely that your idea will be disruptive like ‘no other’ and it will have a significant impact on the ヘルスケア or it is just another way to look at the things. There is also a possibility that your product will help to resolve some of the current challenges for example ‘form factor’ and bulkiness of the spirometer device was a huge challenge until the discovery of portable, hand-held spirometer devices. Similarly, the discovery of blood glucose monitors was transformative like no other for millions of diabetics.
非日常性や破壊性のある医療機器を設計する必要はなく、既存のユーザーに付加価値を与えられる医療機器であれば、BlueStarのような医療機器としてのソフトウェアのように、ユーザーにメリットを提供できる可能性があります。 [1] は、糖尿病患者の生活習慣や薬の管理をサポートする製品です。医療機器メーカーにとって最大のジレンマは、自社の医療機器が市場で収益性の高いシェアを獲得できるかどうかです。多くの場合、この問題は医療機器の品質管理や有効性、あるいは医療機器を市場に投入する際の複雑さに起因します。医療機器のスタートアップ企業にとって、プロセス全体を指導する専門家がいなければ、どちらもプロジェクトの頓挫につながると言えるでしょう。場合によっては、市場を破壊し、新しい治療法をもたらす可能性のある医療機器を設計していても、そのような機器が持つ規制要件を考えていなかったり、規制当局がその機器を分類できなかったりすることがあります。私はある企業と提携していましたが、その企業は治療機器と診断機器を組み合わせてエンドユーザーにエンドツーエンドのメリットを提供するという素晴らしいアイデアを持っていましたが、規制当局はその機器を医薬品として審査するか、510(k)で診断機器として審査するかで混乱していました。したがって、設計の妥当性、品質管理、規制の枠組みのすべての側面を考慮した総合的なアプローチが、必要なときに必要なだけ取り組むよりも賢明な方法です。そのためには、製品のアイデア出しから設計・開発、コンプライアンス、試験、スケールアップ、マーケティングに至るまで、すべての段階で正確さが求められます。
今回は、医療機器の開発プロセスのうち、「設計・開発」の段階をご紹介します。この段階は、医療機器のライフサイクルの中で最も重要な段階だと思われます。医療機器のスタートアップ企業として、医療機器の定義や設計において重要なステップを省いてしまうと、規制機関への不適合のリスクがあり、医療機器を市場に出すことができなくなります。定義や設計が不十分な医療機器は、規制のハードルを回避することに成功したとしても、最終的には、使用目的や、先行者や競合他社に対する利点などの主張を実現することができないかもしれません。一方、しっかりと定義・設計された製品は、市場を混乱させ、最終的には市場に採用される可能性を多く秘めています。
医薬品であれ医療機器であれ、すべてのヘルスケア製品と同様に、顧客の要求を満たす適切なソリューションを提供するためには、かなりの努力と細心の注意が必要です。医療機器メーカーのスタートアップ企業としては、製品のスコープ、成果物、定義、仕様、デザイン、フォームファクタ、リスク軽減戦略、規制要件などについて、すべての関係者が一致していることを確認する必要があります。基本的には、上記のすべての努力が、医療機器の最高の品質に向けて推進されるべきです。
医療機器開発。製品から開発段階まで
1.商品のアイデアとコンセプトの策定
The first step in medical device innovation is to analyze and identify the medical device market. As mentioned above, you are analyzing to see if your device is meeting unmet medical needs like early diagnosis of a difficult to cure disease or it is providing a more efficient way to manage a chronic disease. The problem statement for your medical device could be a novel or a better way to monitor adherence to the treatment regimen, monitoring ailment and health, improving drug delivery minimizing the drug requirements and adverse drug events, using 人工知能, 機械学習, deep learning, or real-world insights etc. Innovative software can also be defined and approved as a medical device under a software as a medical device (SaMD) category.
需要のあるニーズを特定することは、コンプライアンスに対応することとは別に、医療機器を提供するための主要なステップです。これが成功するかどうかは、2つのことに大きく左右されます。
- ターゲット市場のニーズと、医療機器開発者が認識しているニーズとのギャップであり、ギャップが少ないほど製品定義のためのインプットになる。
- 市場のニーズを分析することで、強力な製品定義が抽出されます。
医療機器の開発プロセスの全体像は、下図1のように簡略化することができます。
医療機器のスタートアップ企業としては、科学的・工学的なイノベーションを、規制当局の決定プロセスを水平方向に素早く移動するための敏捷性で裏付けることが重要であり、これは医療機器開発プロセスの各段階に戦略的なチェックポイントを設けることで実現できます。製品のライフサイクルの観点から考えると、アイデアの着想から市場投入、薬事承認から市場導入に至るまで、常に課題に直面することになります。つまり、課題と医療機器開発は結びついていて、それを解きほぐす唯一の方法は、開発側では科学的・技術的なモメンタム、承認側では科学的根拠に基づく規制当局の意思決定です。
2.デバイスの分類
製品のアイデアと特性の定義が終わったら、次のステップは、機器のリスクベースの規制上の分類を確認することです。製品に関連するリスクを明確にし、参入する規制市場に基づいて適切なクラスを選択する必要があります。この段階では、機器の使用目的が明確に定義されていることを確認する必要があります。これは非常に重要なことで、510(k)を計画している場合は、機器の使用目的がプレディケート機器と一致していることを確認してください。
米国や欧州委員会など、どの地域で医療機器を申請しようとしているかによって、医療機器分類パネル(Medical Device Classification Panel)による分類が必要になります。米国FDAの医療機器分類)またはMEDDEV 2.4/1 Rev.9 (ENガイダンス MEDDEV)をそれぞれ作成します。提出物の中で最も大きな部分を占めるのが、医療機器分類のセクションです。このセクションでは、お客様の機器に対する規制要件を定義します。選択した医療機器クラスに応じて、規制当局が発行した既存のガイダンス文書を確認することをお勧めします。例えば、米国では、FDAがすでにガイダンス文書を発行している可能性がありますが、その半分はあなたのアプリケーションに関連しています。このようなガイダンスは、迅速な審査サイクルや最初の申請での承認の可能性を高めるための参考資料となります。これらのガイダンス文書は、貴社のような革新的な医療機器企業と、FDAの審査官の両方に、申請の迅速な審査を指導するために発行されています。また、提案されたアイデアや類似したものに関する既存の知的財産がないかどうかを確認する必要があります。発見段階を完全に遂行するためには、強力な開発チームが不可欠です。経験豊富なチームでないと、これが落とし穴になるかもしれません。いずれにしても、社内のチーム、コンサルタント、医療機器エンジニアリング会社のいずれかを選択することになります。
企業が社内のコンサルタントや外部の人材を探す際に考慮するポイントは 医療機器コンサルタント は、次のような分野の専門知識を持っている必要があります。
- エンジニアリングとデザイン
- ヒューマンファクターとユーザビリティーエンジニアリング
- 医療業界の臨床的・科学的知識
- Regulatory affairs and quality assurance
- 知的財産法
3.ディスカバリー・フェーズ
The discovery phase where you will take your idea into the initial designing stage and develop prototypes for your device. This stage involves a lot of brainstorming with engineers, design consultants and your team to make 3D prototypes through simulations and computer-assisted designs and test those prototypes for proof-of-concept. You should also start looking at the FDA guidance documents to find out which critical functionality tests are pertinent to your device and start using them as a decision-matrix for finalizing the ideal design of your device. For the startups which are still boot-strapping for finances, it will be cost-prohibitive to run all the tests as per the guidance documents so I would rather advise to choose one or two most relevant tests and use them for design optimization. Once you have optimized your medical device concept and design, you may now proceed for regulatory approval and commercialization. It is noteworthy here that the US FDA critical path initiative focused on the science of development: better toxicology, バイオマーカー, improved 臨床試験しかし、この構想は、1990年代のリエンジニアリング構想や機器使用料に伴う法改正を含む他の構想と同様、承認プロセスの規制構造そのものや、規制構造が開発の科学における選択をどのように決定するかを検証するものではありませんでした。
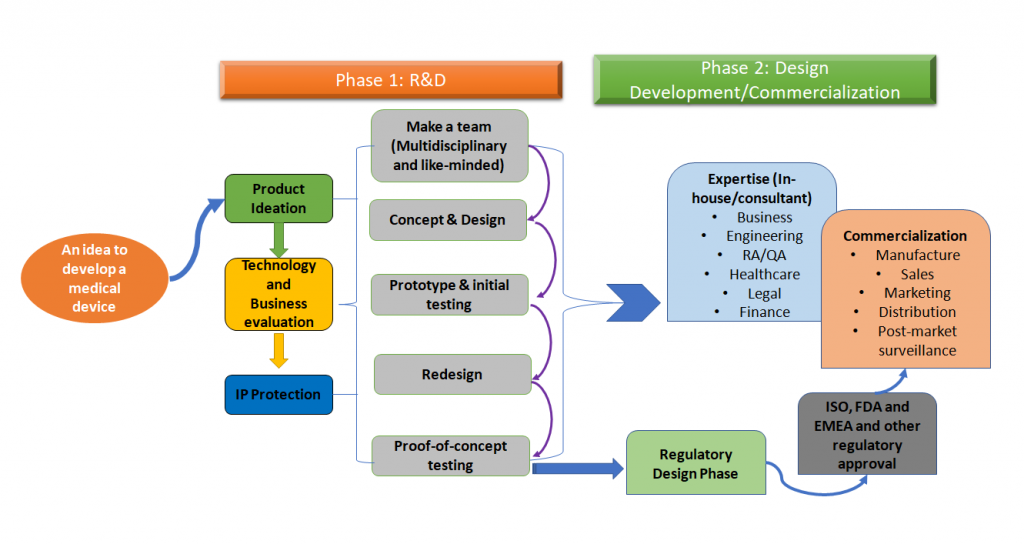
図1: 医療機器の開発は、全体的なプロセスです。これはフェーズごとのアプローチであるプロセスの簡易版ですが、理想的には、医療機器開発の初期段階で、このプロセス全体のすべてのステップをマッピングする必要があります(Adapted from [1,2]).
医療機器の開発にお困りですか?見る 医療機器コンサルタント をKolabtreeに掲載しました。専門家への問い合わせやプロジェクトの投稿は無料です。
も読んでください。 医療機器のコンサルタントを雇うには、どのくらいの費用がかかりますか?
リファレンス
- https://www.welldoc.com/health-plans/
- https://ec.europa.eu/docsroom/documents/10337/attachments/1/translations
- FDA, 2005, Total Product Lifecycle, FDA-CDRH Presentation by CDRH Director Dr David Feigal, http://www.fda.gov/cdrh/strategic/presentations/ tplc.html.
このシリーズの全記事
医療機器の開発・設計のための決定版ガイド
医療機器開発。成功のための3つのヒント
医療機器のデザイン。The Essential, Step-by-Step Guide
医療機器の商品化:スケッチから発売までの9つのステップ
医療機器の商業化の課題をどう克服するか
医療機器のローンチ製品を市場に投入するための重要なステップ
医療機器の市販後調査。包括的なガイド







