A relatório de avaliação clínica (CER) is a technical document required by dispositivo médico companies that want to sell or distribute products in Europe. The CER provides a comprehensive overview of the medical device design and composition, intended usage and applications, ensaios clínicos análise e resultados, revisões de literatura relevante, protocolos e instruções de uso.
Marcação UE MDR e CE
Medical devices in Europe need to get a “CE Mark”, which indicates that the product complies with the EU regulations (MDD, MDR or IVDR, whichever is applicable). The recent Medical Device Regulations in Europe has significantly impacted the way medical devices are regulated and approved in the EU. The MDR is the biggest change to medical device legislation in over 20 years. Some major changes in the MDR (as compared with the MDD) include device classification, technical file documentation, traceability and post-market surveillance.
Leia mais: As melhores dicas para obter a marca CE para seu dispositivo médico
Relatório de Avaliação Clínica
The MDR places great emphasis on Clinical Evaluation Reports or CERs. The CER forms part of the Technical File, which is the main documentation which demonstrates conformidade regulamentar and provides all the information about the device. Medical device companies need to take several measures to make sure that their CER is well-prepared and well-maintained. CER documentation typically comprises 4 stages:
- Definir o escopo do dispositivo, seu uso pretendido e suas reivindicações terapêuticas/diagnósticas
- Identificação e validação de dados clínicos
- Analisar os dados e interpretá-los para ver se atendem a todos os requisitos
- Identificação de riscos e incertezas, que podem ser respondidos durante a vigilância pós-comercialização (PMS)
Um CER precisa ser atualizado regularmente ao longo de todo o ciclo de vida de um dispositivo médico. O documento deve conter as provas clínicas que suportam a prova de conformidade com os Requisitos Essenciais (RE) no MEDDEV 2.7/1 Rev. 4 Anexo 1 (Requisitos de Segurança e Desempenho no MDR). O documento também deve descrever os aspectos físicos e técnicos e a composição do dispositivo, juntamente com as instruções de uso.
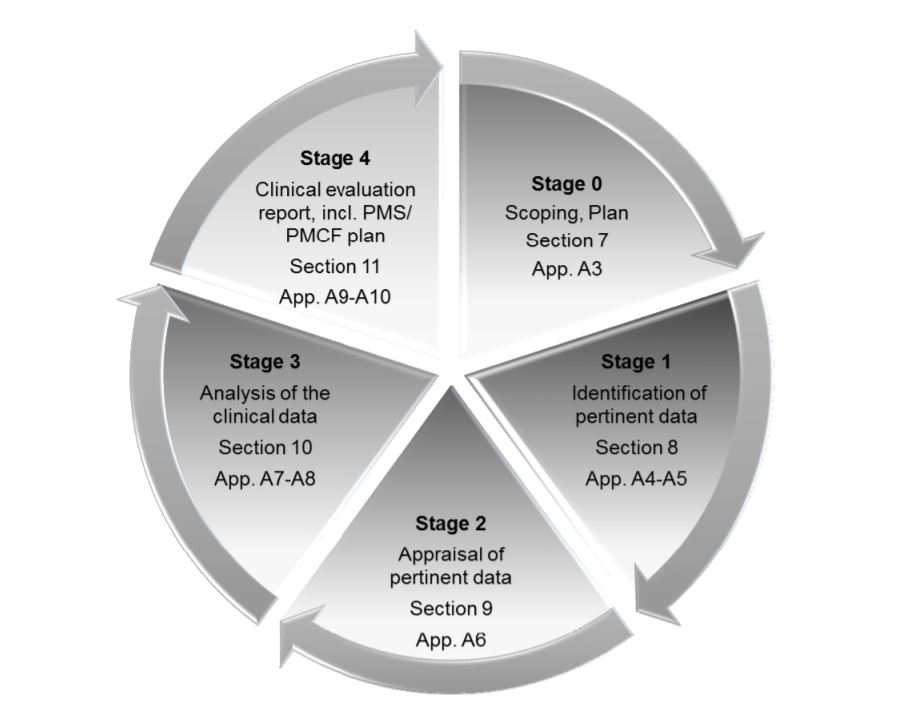
As quatro etapas do CER, conforme descritas em MEDDEV 2.7/ rev. 4.
Equivalência
Os fabricantes de dispositivos médicos precisam avaliar os dados clínicos de seu próprio dispositivo médico ou de um dispositivo equivalente, cuja segurança e desempenho clínico não sejam diferentes. Sob o MDR, o fabricante de dispositivos médicos tem que considerar três fatores para provar que um produto é equivalente: biológico, técnico e clínico.
Equivalência técnica significa que o dispositivo deve ter as mesmas especificações de projeto e composição, e deve ser utilizado nas mesmas condições, com o mesmo método de implantação e princípios operacionais. Equivalência clínica significa que o dispositivo deve ser usado para tratar a mesma condição, no mesmo local do corpo e para o mesmo grupo de população, alcançando desempenho semelhante.
Equivalência Biológica significa que o dispositivo médico em questão não deve causar qualquer risco biológico.
Se um dispositivo médico for incapaz de demonstrar equivalência, eles têm que realizar uma investigação clínica adicional ou remover a reivindicação de seu produto.
Revisão da Literatura
Um forte processo de revisão de literatura precisa ser estabelecido para que toda a literatura publicada relevante para o dispositivo seja facilmente acessível e possa apoiar a alegação que está sendo feita. As revisões de literatura normalmente precisam da experiência de um pesquisador especializado que possa identificar o termo de pesquisa correto, usar bancos de dados como PubMED ou MEDLine, encontrar literatura relevante e avaliá-la, inclusive usando referências relevantes. A revisão da literatura também deve abordar quaisquer questões que os dados clínicos não sejam capazes de responder.
Quanto tempo leva para escrever um CER?
Identificar e reunir todos os dados que entram no CER e preparar o documento de acordo com as diretrizes pode levar várias semanas ou meses. A vigilância pós-comercialização (PMS) constitui uma grande parte do processo mesmo após a certificação da marca CE, e o PMS tem que ser uma parte central do Sistema de Gestão de Qualidade (QMS) dos fabricantes. Alguns casos também requerem Acompanhamento Clínico Pós-Mercado (PMCF) que envolve a coleta proativa de dados clínicos e sua avaliação para atender às exigências de segurança e desempenho.
O CER não é um documento estático. É recomendado que os fabricantes de dispositivos médicos desenvolvam um processo robusto e uma estratégia incorporando boas práticas para ajudá-los a manter o acesso ao mercado na UE, evitar qualquer recall de produtos e agilizar o tempo e os recursos usados para manter o documento.
A terceirização da escrita do CER para um especialista freelance pode ajudar a economizar tempo e energia preciosos. Autores de relatórios de avaliação clínica freelance são capazes de desenvolver RCEs a partir de USD 3.000 em Kolabtree.
Redatores de Relatórios de Avaliação Clínica
The time and expertise required to put together a CER can be a resource strain for several medical device startups or medical device SMBs, who may not have in-house specialists. Working with external experts, including freelance CER writers, clinical data analysts, literature review experts biostatisticians and escritores médicos can help companies make sure that their CER strategy is robust and their data is all verified and accurate.
Como contratar um redator freelancer CER
As habilidades a serem procuradas em um redator CER incluem experiência em lidar com regulamentos e processos de aprovação de dispositivos médicos, familiaridade com a MEDDEV 2.7/ rev. 4, conhecimento de áreas terapêuticas e forte capacidade analítica. O pool global de especialistas da Kolabtree inclui especialistas qualificados Redatores de relatórios de avaliação clínicaque pode ajudá-lo a montar um CER bem pesquisado e minucioso. É livre para publicar seu projeto e obter citações de especialistas. Comece
Peritos relacionados:
Consultores de Produtos médicos | Escritor Médico Freelancer | Escritor autônomo do CER | Consultores MDR da UE | Envios da FDA | Especialistas em Pesquisa de Literatura | Peritos em Conformidade Regulatória | Especialista em ensaios clínicos | Escritores Reguladores | Consultores PMS | Consultores da PMCF | Especialistas em Bioestatística | Especialista em desenvolvimento de produtos







