Kolabtree freelance biostatistician consultant, Rudra Patel provides a comprehensive guide on how to develop a Statistical Analysis Plan (SAP) for Sperimentazioni cliniche.
1. Piano di analisi statistica (SAP) in uno studio clinico (CT)
Un piano di analisi statistica (SAP) ben scritto e completo è importante per aumentare la qualità degli studi clinici e renderlo più valido e generalizzato.
SAP is a defined outline of the planned statistical basic/advance methods for the analyses for a clinical trial and is written in study protocol as well as separately. SAP is crucial and is one of the key Regulatory confidential documents in the development of a clinical trial. An SAP is a more challenging task in a clinical trial protocol development that requires a strong command on statistical methodology, medical terminology and visualization power. It provides explicit guidance on statistical programming and the presentation of results for clinical trial. The following four important types of SAP are used in a clinical trial (Figure 1).
- Monitoraggio dei dati
- Analisi statistica intermedia
- Piano integrato di analisi statistica
- Piano di analisi statistica per lo studio clinico
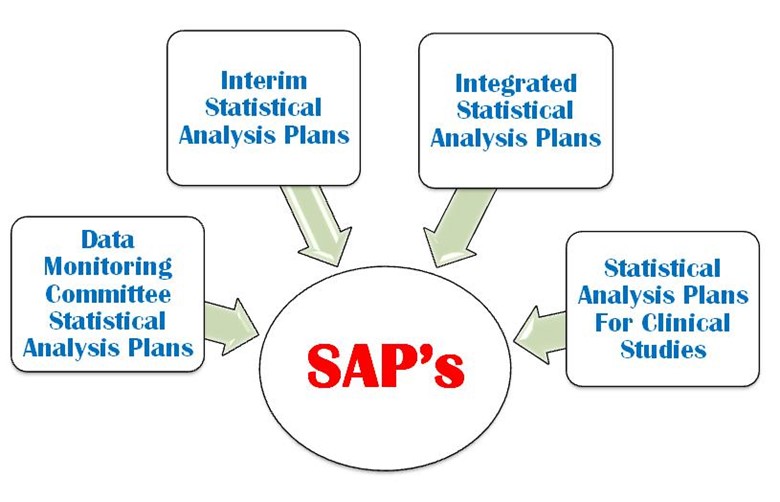
Figura 1: Quattro importanti tipi di SAP sono utilizzati in una CT
The SAP is mostly written as a separate document or it is included in CT study protocol as a standard operating procedure for dealing with the statistical part of the clinical study. A team statistico medico/biostatistician is in-charge of developing the SAP in coordination with the principal investigator of the CT study. The document should be reviewed by Senior Biostatistician and finalized before to submission to the review board and regulatory authorities. If any protocol amendments are done, then the SAP is amended as well.
The SAP must properly explain following the aims and primary objectives, secondary objective, exploratory objectives, primary/secondary/exploratory endpoints, trial population, design of the trial, sample size calculations with justifications/assumptions, and the randomization methods. Additionally, an SAP must describe in detail the statistical methodology i.e. efficacy analysis, safety analisi dei dati, reporting conventions, etc. Figure 2 shows the most important points that need to be considering when developing SAP in the clinical trial study protocol.
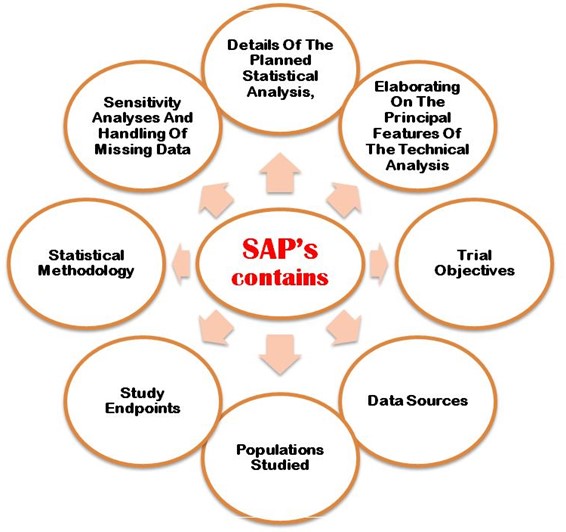
Figura 2: Dettagliati punti importanti da considerare nello sviluppo della SAP nel protocollo CT.
Il piano di analisi sviluppato dovrebbe essere rivisto con particolare attenzione e approvato da un biostatistico senior in cieco prima del blocco del database da parte delle autorità. Ahrweiler et al. 2011 Il documento della conferenza pubblicato online ha spiegato l'importanza del piano di analisi statistica di revisione. I seguenti punti dettagliati importanti da considerare nello sviluppo della SAP nel protocollo CT,
- Dettagli dell'analisi statistica prevista
- Elaborare le caratteristiche principali dell'analisi tecnica.
- Obiettivi della prova
- Fonti di dati
- Popolazione studiata
- Punti finali dello studio
- Metodologia statistica
- Analisi di sensibilità e dati mancanti
Il SAP dello studio clinico dovrebbe essere sviluppato con una discussione approfondita tra lo studio, gli investigatori principali e lo statistico. Di seguito sono indicati il ruolo e la responsabilità dello statistico,
- Scrivere una dichiarazione di ricerca o ipotesi dello studio clinico.
- Determinare gli endpoint primari e gli endpoint secondari.
- Scoprire e sviluppare una strategia per ridurre i bias e la selezione della dimensione del campione per la sperimentazione clinica
- Definire tutti i metodi statistici appropriati per l'analisi dei dati degli studi clinici
Nello sviluppo di SAP nella sperimentazione clinica bisogno di spiegare in profondità chiave evidenzia punti. Yuan et al.2019 hanno pubblicato un articolo di interesse speciale su "Guida al piano di analisi statistica" [Figura 2]. L'articolo fornisce in modo approfondito la SAP di un reale studio di ricerca di sperimentazione clinica è quello di fornire una guida pratica dettagliata sulla scrittura di una SAP efficace. Inoltre nello stesso articolo discusso dove cosa, perché di un SAP, quando e chi, ed evidenziare i contenuti chiave del SAP. La necessità per lo studio di ricerca di sperimentazione clinica di ben scritto e documentato SAP, in particolare per gli studi di regolamentazione.
2. Importanza del piano di analisi statistica negli studi clinici
La CT è condotta su tutti i nuovi processi di sviluppo di farmaci/medicine e dispositivi medici. Dall'ultimo decennio, l'aumento del tasso di pazienti reclutati in studi clinici per lo sviluppo di farmaci/medicine proviene dall'Europa e dagli Stati Uniti, oltre che dai paesi in via di sviluppo.
Negli studi clinici, il SAP è uno dei documenti più importanti. Assicura che le analisi per valutare tutte le ipotesi di studio pre-pianificate siano condotte in modo scientificamente valido e che tutte le decisioni siano documentate. Fornisce anche dettagli approfonditi su come i risultati saranno presentati e riportati in CT.
Gli studi clinici sono utilizzati per valutare i benefici aggiuntivi e migliorare gli interventi in campo medico. assistenza sanitaria. The more important thing to consider while conducting a clinical trial is to execute the trial with minimum bias. Therefore, each clinical trial to have a clear and detailed SAP to its support to reproducibility. For the best practice of CT scientific research studies, reproducibility of research, and to avoid concerns of misuse of clinical research, a clear detailed and very transparent SAP much be needed, to improve trial conduct and reporting. Following are three essential roles of SAP needs to maintain in conducting CT.
- Trasparenza: Trasparenza su come procederà l'analisi, specificando in anticipo la metodologia che sarà applicata
- Comunicazione: Comunicazione chiara a tutte le persone coinvolte nello studio su come procedere
- Replicazione: Facilita la replica in modo che un futuro team di ricerca possa seguire gli stessi passi per confermare i risultati sullo stesso o su un nuovo campione.
Come da linee guida standard con le migliori pratiche, è importante che lo statistico/biostatistico del progetto di sperimentazione clinica prepari un SAP di studio prima dell'inizio della sperimentazione clinica, dettagliando tutte le analisi pianificate, i parametri dello studio, comprese le definizioni dei set di analisi e la metodologia statistica di base/avanzata.
Inoltre, alcune altre considerazioni importanti relative alla SAP in CT includono:
- Un modo per minimizzare i bias è quello di rendere cieco il biostatistico.
- Il SAP dovrebbe essere documentato in modo tale che tutte le manipolazioni dei dati e le analisi effettuate possano essere replicate.
- Un Trial Master File deve essere mantenuto con tutta la documentazione pertinente al completamento della sperimentazione da parte del biostatistico.
Il piano di analisi sistematicamente organizzato aiuta il team dello studio clinico ad essere insieme sulla stessa pagina e aggiunge un altro livello di specificità al CT. Descrive la metodologia statistica sistematicamente pianificata di uno studio di ricerca di sperimentazione clinica. Rispetto al protocollo della sperimentazione clinica, il SAP è un documento tecnico approfondito in cui sono descritte in dettaglio le tecniche statistiche per la progettazione dello studio e l'analisi dei dati della sperimentazione clinica. Mentre scriviamo le SAP generalmente seguiamo le linee guida ICH E3 ed E9. Questo ci dà un'idea del contenuto del corpo delle singole sezioni del SAP. Ma E3 ed E9 non specificano tecniche statistiche specifiche.
Migliorare la riproducibilità, la trasparenza e la validità degli studi clinici. Istituti nazionali di salute (NIH) ha pubblicato "Rules for clinical trials studies registration and results information submission", nel senso che impone la registrazione della sperimentazione, la pubblicazione del reclutamento o dei risultati della sperimentazione clinica in corso su ClinicalTrials.gov, e la presentazione del documento originale separato statistical analysis plan (SAP) insieme al protocollo dello studio di ricerca della sperimentazione clinica.
Il grande contributo dello statistico medico/biostatistico a parte lo sviluppo di una SAP standard è la progettazione, il monitoraggio e l'analisi dei dati degli studi clinici.
3. Lista di controllo/linee guida dettagliate per le SAP negli studi clinici
Nello sviluppo delle SAP di CT, dobbiamo prendere in considerazione tutte le dettagliate checklist/linee guida standard. Le linee guida importanti utilizzate nello sviluppo delle SAP sono ICH E9 (Conferenza internazionale per l'armonizzazione dei requisiti tecnici dei prodotti farmaceutici per uso umano) e SPIRIT (Standard Protocol Items: Recommendations for Interventional Trials).
La trasparenza e la riproducibilità sono state un termine fondamentale che aggiunge valore ai dati degli studi clinici. Tuttavia, l'influenza della metodologia statistica influisce direttamente sul processo decisionale della sperimentazione clinica, una condotta statistica ben documentata, mantenuta confidenziale e trasparente è essenziale. Gli esperti di statistica medica/biostatistica possono aiutare a sviluppare le SAP secondo le linee guida standard.
Secondo ICH E9 i SAP, solitamente noti come piani di reporting e analisi, possono anche essere conosciuti come piani di analisi dei dati (DAP) o piani di analisi statistica (SAP) in altre organizzazioni. Le linee guida ICH E9 affermano che "le caratteristiche principali dell'eventuale SAP dei dati dovrebbero essere descritte nella sezione statistica del protocollo". Tuttavia, le linee guida SPIRIT (Standard Protocol Items: Recommendations for Interventional Trials) fanno riferimento a un SAP separato.
Il SAP è un documento essenziale in CT che deve essere riferito alle autorità di regolamentazione (per esempio Food and Drug Administration (FDA), Agenzia europea per i medicinali (EMA)). Le linee guida standard suggeriscono che il SAP deve essere conservato nel master file confidenziale della sperimentazione clinica e viene utilizzato durante gli audit delle autorizzazioni normative per controllare se i documenti statistici hanno seguito esattamente le linee guida standard.
Il SAP è il documento più comunemente usato per guidare gli statistici. In generale, i seguenti elementi dovrebbero essere inclusi in una SAP (Figura 3).
Lo statistico deve essere riferito a Il Dichiarazione CONSORT (e qualsiasi estensione) e anche ICH E9 Principi statistici per gli studi clinici (PDF, 325 KB).
- Stazione di pianificazione e progettazione della prova
- La rete EQUATOR- Un centro di risorse per un buon reporting degli studi di ricerca sulla salute.
- Il sito web CONSORT
- Nel 2017 le linee guida pubblicate da Gamble et al.2017, le linee guida di questi articoli raccomandano un minimo di 55 elementi importanti che dovrebbero essere considerati quando si sviluppa una SAP seguente.
- Titolo e registrazione
- Introduzione
- Metodi di studio
- Principi statistici
- Popolazione di prova
- Analisi
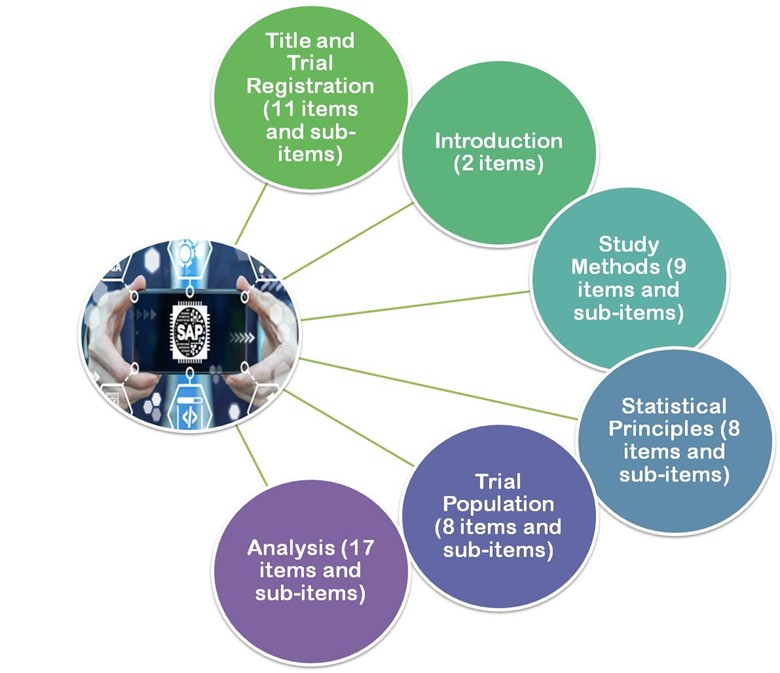
Figura 3: Gamble et al. 2017, le linee guida sono divise in 6 sezioni principali.
4. In cosa consiste una SAP?
A lista di controllo di 32 liste di controllo dettagliate per sviluppare il Lista di controllo del piano di analisi statistica (SAP) (Word). L'intenzione primaria di essere più applicabile alle analisi finali dei CT così come ai CT randomizzati in fase successiva. Le linee guida più importanti sviluppate dalla FDA Guida per l'industria: Principi statistici per le sperimentazioni cliniche.
Le seguenti linee guida e raccomandazioni per il contenuto di una SAP:
- Il SAP non è un documento a sé stante e deve essere letto insieme al protocollo dello studio clinico.
- Il protocollo dello studio clinico deve essere coerente con i principi del Dichiarazione SPIRIT 2013.
- Il SAP deve essere applicato a un set di dati puliti o convalidati per l'analisi.
Linee guida dettagliate sviluppate attraverso finanziatori, autorità di regolamentazione, riviste, rappresentanti dell'industria e Unità di sperimentazione clinica registrate dalla UK Clinical Research Collaboration (UKCRC CTU). Le linee guida per il contenuto dei piani di analisi statistica negli studi clinici descrivono in dettaglio JAMA. Tuttavia, una spiegazione dettagliata più approfondita di ogni lista di controllo per voce può essere trovata nel documento di elaborazione. La dichiarazione SAP inclusa è anche inclusa nel Rete Equator e MRC-NIHR Partenariato di ricerca sulla metodologia dei test (TMRP). Di seguito sono riportati i documenti chiave e i link fondamentali utilizzati nello sviluppo delle SAP negli studi clinici (Figura 4).
- Documento chiave
- Lista di controllo
- Elaborazione
- Documento JAMA
- Collegamenti chiave
Figura 4: Documenti chiave e collegamenti chiave utilizzati nello sviluppo delle SAP in studi clinici
5. Assumere uno statistico clinico freelance per aiutare con le SAP
Lo sviluppo di una SAP spesso richiede il supporto di uno statistico clinico freelance. Con l'aiuto di un biostatistico esperto, puoi sviluppare una SAP completa e senza errori, che migliorerà la qualità dei tuoi studi clinici.
Sfogliare consulenti in studi clinici su Kolabtree ora ed entra direttamente in contatto con un esperto.







