A informe de evaluación clínica (CER) is a technical document required by dispositivo médico companies that want to sell or distribute products in Europe. The CER provides a comprehensive overview of the medical device design and composition, intended usage and applications, ensayos clínicos análisis y resultados, revisiones bibliográficas pertinentes, protocolos e instrucciones de uso.
MDR de la UE y marcado CE
Medical devices in Europe need to get a “CE Mark”, which indicates that the product complies with the EU regulations (MDD, MDR or IVDR, whichever is applicable). The recent Medical Device Regulations in Europe has significantly impacted the way medical devices are regulated and approved in the EU. The MDR is the biggest change to medical device legislation in over 20 years. Some major changes in the MDR (as compared with the MDD) include device classification, technical file documentation, traceability and post-market surveillance.
Lea más: Consejos para obtener el marcado CE de su producto sanitario
Informe de evaluación clínica
The MDR places great emphasis on Clinical Evaluation Reports or CERs. The CER forms part of the Technical File, which is the main documentation which demonstrates cumplimiento de la normativa and provides all the information about the device. Medical device companies need to take several measures to make sure that their CER is well-prepared and well-maintained. CER documentation typically comprises 4 stages:
- Definir el ámbito de aplicación del producto, su uso previsto y las reivindicaciones terapéuticas/diagnósticas
- Identificar y validar los datos clínicos
- Analizar los datos e interpretarlos para ver si cumplen todos los requisitos
- Identificar los riesgos y las incertidumbres, a los que se puede responder durante la vigilancia posterior a la comercialización (PMS)
Un RCE debe actualizarse periódicamente a lo largo del ciclo de vida de un producto sanitario. El documento debe contener las pruebas clínicas que respalden la conformidad con los Requisitos Esenciales (RE) del Anexo 1 del MEDDEV 2.7/1 Rev. 4 (Requisitos de seguridad y funcionamiento en el MDR). El documento también debe describir los aspectos físicos y técnicos y la composición del producto, junto con las instrucciones de uso.
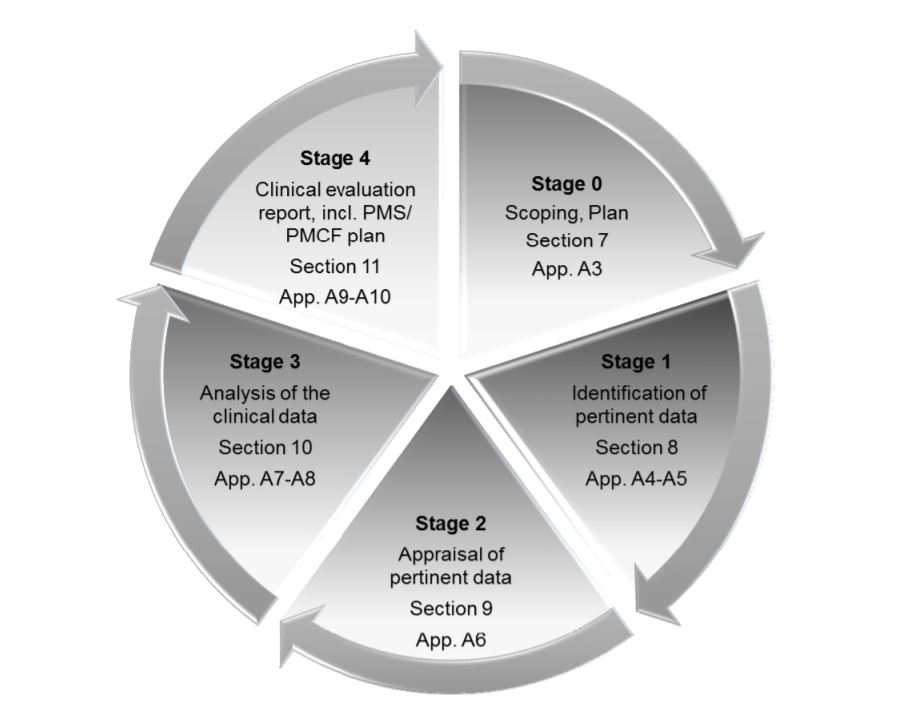
Las cuatro etapas de la RCE, tal y como se describen en MEDDEV 2.7/ rev. 4.
Equivalencia
Los fabricantes de productos sanitarios tienen que evaluar los datos clínicos de su propio producto sanitario o de un producto equivalente, cuya seguridad y rendimiento clínico no es diferente. De acuerdo con el MDR, el fabricante de productos sanitarios tiene que considerar tres factores para demostrar que un producto es equivalente: biológico, técnico y clínico.
Equivalencia técnica significa que el dispositivo debe tener las mismas especificaciones de diseño y composición, y debe utilizarse en las mismas condiciones, con el mismo método de despliegue y principios operativos. Equivalencia clínica significa que el dispositivo debe utilizarse para tratar la misma afección, en el mismo lugar del cuerpo y para el mismo grupo de población, logrando un rendimiento similar.
Equivalencia biológica significa que el producto sanitario en cuestión no debe causar ningún riesgo biológico.
Si un producto sanitario no puede demostrar la equivalencia, tiene que llevar a cabo más investigaciones clínicas o retirar la declaración de su producto.
Revisión de la literatura
Los resultados de la búsqueda bibliográfica constituyen una parte fundamental del informe de evaluación clínica. Es necesario establecer un proceso sólido de revisión bibliográfica para que toda la literatura publicada relevante para el dispositivo sea fácilmente accesible y pueda respaldar la afirmación que se hace. Las revisiones de la literatura suelen requerir la experiencia de un investigador experto que pueda identificar el término de búsqueda correcto, utilizar bases de datos como PubMED o MEDLine, encontrar la literatura pertinente y valorarla, incluyendo el uso de referencias relevantes. La revisión bibliográfica también debe abordar cualquier pregunta que los datos clínicos no puedan responder.
¿Cuánto tiempo se tarda en escribir un CER?
Identificar y recopilar todos los datos que forman parte del RCE y preparar el documento de acuerdo con las directrices puede llevar varias semanas o meses. La vigilancia posterior a la comercialización (SPM) constituye una parte importante del proceso, incluso después de la certificación de la marca CE, y la SPM tiene que ser una parte fundamental del sistema de gestión de la calidad (SGC) del fabricante. En algunos casos también se requiere un seguimiento clínico postcomercialización (PMCF) que implica la recopilación proactiva de datos clínicos y su evaluación para cumplir los requisitos de seguridad y rendimiento.
El RCE no es un documento estático. Se recomienda que los fabricantes de productos sanitarios desarrollen un proceso y una estrategia sólidos que incorporen buenas prácticas para ayudarles a conservar el acceso al mercado de la UE, evitar cualquier retirada de productos y racionalizar el tiempo y los recursos utilizados para mantener el documento.
Subcontratar la redacción del CER a un experto autónomo puede ayudar a ahorrar un tiempo y una energía preciosos. Redactores autónomos de informes de evaluación clínica pueden elaborar RCE a partir de 3.000 dólares en Kolabtree.
Redactores de informes de evaluación clínica
The time and expertise required to put together a CER can be a resource strain for several medical device startups or medical device SMBs, who may not have in-house specialists. Working with external experts, including freelance CER writers, clinical data analysts, literature review experts biostatisticians and escritores médicos can help companies make sure that their CER strategy is robust and their data is all verified and accurate.
Cómo contratar a un redactor autónomo de CER
Entre las aptitudes que hay que buscar en un redactor de RCE figuran la experiencia en el manejo de reglamentos y procesos de aprobación de productos sanitarios, la familiaridad con MEDDEV 2.7/ rev. 4, conocimiento de las áreas terapéuticas y gran capacidad de análisis. El grupo global de expertos de Kolabtree incluye a personas cualificadas Redactores de informes de evaluación clínicaque pueden ayudarle a elaborar un CER bien documentado y exhaustivo. Es gratis publicar su proyecto y obtener presupuestos de expertos. Empezar a trabajar
Expertos relacionados:
Consultores de dispositivos médicos | Escritor médico autónomo | Escritor autónomo de CER | Consultores de MDR de la UE | Presentaciones a la FDA | Expertos en búsqueda de bibliografía | Expertos en cumplimiento normativo | Experto en ensayos clínicos | Redactores de normativas | Consultores de PMS | Consultores de PMCF | Expertos en bioestadística | Experto en desarrollo de productos







